熱レンズ顕微鏡による紫外励起無標識検出
1.はじめに
タンパク質やDNAなど生体由来試料の分析では、試料が微量であるためマイクロ化学チップの利用が期待されている。
従来、生体分子の分析には紫外吸収法や蛍光法が用いられることが多かったが、光路長が短いために吸光法では測定ができず、
蛍光法では蛍光色素による標識や蛍光タンパク質の導入が必須であった。
そこで、当研究室で開発した熱レンズ顕微鏡(TLM)を紫外波長に対応させれば、生体分子の無標識検出が可能になると考えた。
2.原理
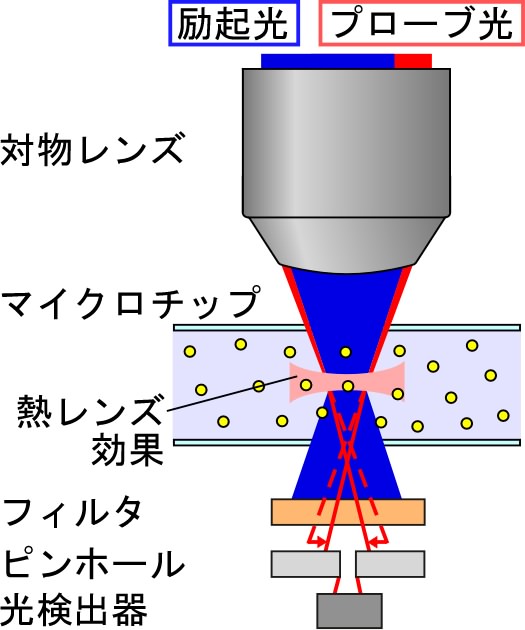
TLMの原理を図1に示す。まず励起光を対物レンズでサンプル溶液に集光すると、光吸収によって熱が放出され、焦点近傍の温度が上昇して屈折率が変化する。
この屈折率変化を熱レンズ効果と呼ぶ。次にプローブ光を入射すると、熱レンズ効果によってプローブ光が屈折し、
ピンホールを通過する光の強度が変化する。ここで励起光のONとOFFを繰り返せば、プローブ光の強度は周期的に変化する(強度変調)。
この変化をロックインアンプを通して取り出したものが熱レンズ信号である。
このとき、変化量は溶液の濃度に比例するので、信号値は濃度に比例する。
一方、励起光を紫外波長とすればタンパク質、ペプチド、DNAなど紫外領域に吸収を持つ分子を検出することも可能であるが、
可視レーザーと異なり紫外域の連続レーザーは出力や安定性に難があった。
そこで、高い繰り返し周波数を持つ小型Nd:YVO4パルスレーザーを擬似的な連続光源と見なして励起光に用いたUV-TLMを着想した。
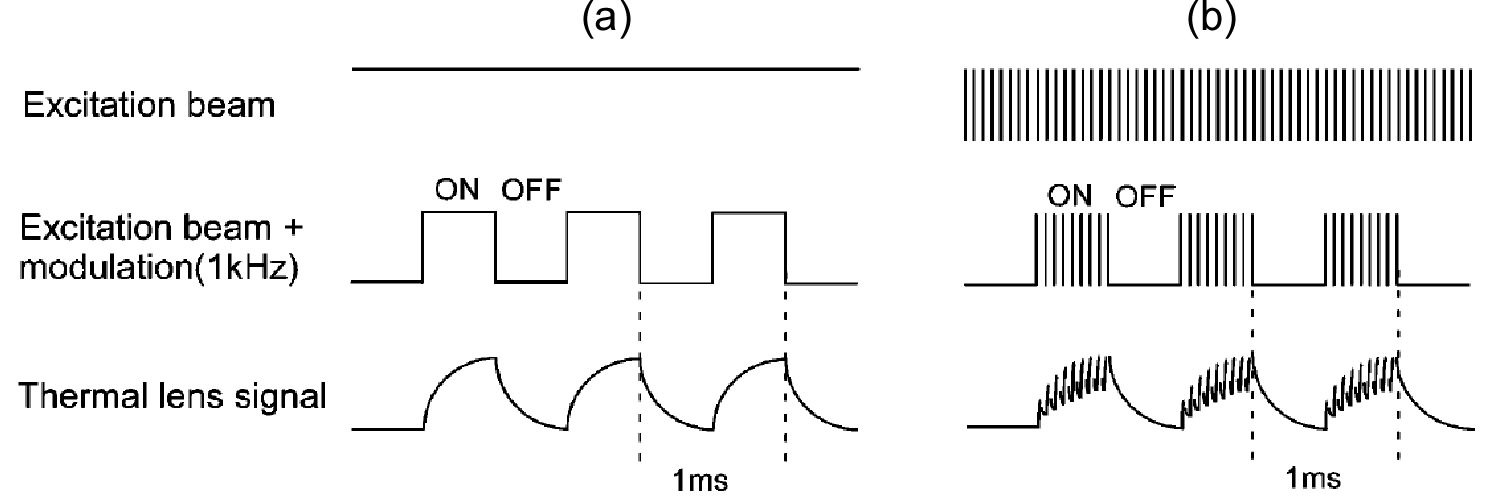
従来の連続波(CW)励起と疑似連続波(QCW)励起の違いを図2に示す。使用したパルスレーザーのパルス幅は22 ns、繰り返し周波数は80kHzで、励起光の強度変調の周波数は
1 kHzである。熱レンズ効果の発生および減衰は十分に遅いから、パルスレーザーを連続光と見なした熱レンズ測定が可能となる。
 |  |
| 図1. TLMの原理 | 図2. CW励起とQCW励起 |
3.実験
励起光源にNd:YVO4パルスレーザーを用いた紫外励起熱レンズ顕微鏡(UV-TLM)に液体クロマトグラフィー(LC)を組み合わせ、
グラジエント溶出法を適用してペプチドの無標識検出を行った。
検量線を作成するための評価用試料として、H-Trp-Glu-Glu-OHとH-Trp−Asp-Asp-Asp-OHのアミノ酸
配列からなる合成ペプチドを用いた。LCの溶媒には水/アセトニトリルを用いた。
4.結果と考察
UV-TLMによって得られた合成ペプチドのクロマトグラムを図3に示す。
溶出時間16分と19分にそれぞれ、H-Trp-Glu-Glu-OHとH-Trp−Asp-Asp-Asp-OHのピークを検出し、
溶媒の熱レンズ信号がバックグラウンドとして現れている。
TLM信号の大きさは溶媒の熱伝導率や屈折率の温度勾配に影響を受けるので、今回のようなグラジエント法を用いた場合溶媒の組成の変化を考慮しなければならないが、
今回の場合熱レンズ信号の溶媒による変化は無視できるレベルであった。
検出法にUV-TLMと吸光光度計をそれぞれ適用した場合について、合成ペプチドの混合比を変えて測定した検量線を図4に示す。
試料濃度が1〜5 µg/mLの範囲で良好な直線関係を示した。
また、検量線から定量下限(2σ)を算出したところ、吸光光度計に比べUV-TLMを用いた場合約10倍高感度になることが分かった。
この定量下限は、バックグラウンドの低減や測定系の改善などの工夫によって更に改善すると考えられる。
本研究によって、LC/UV-TLMシステムが生体由来の微小試料の分析において極めて有効であることが認められたと言える。
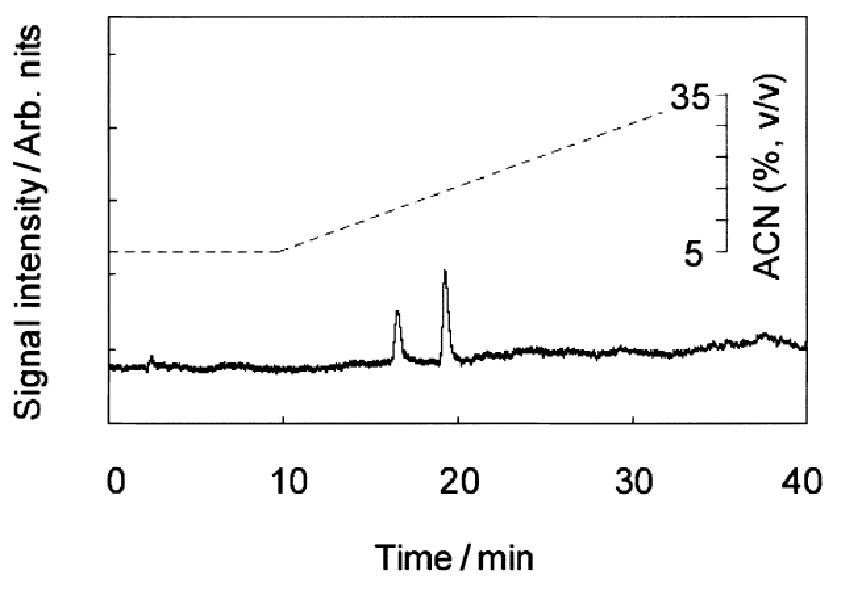
図3. 合成ペプチドのクロマトグラム
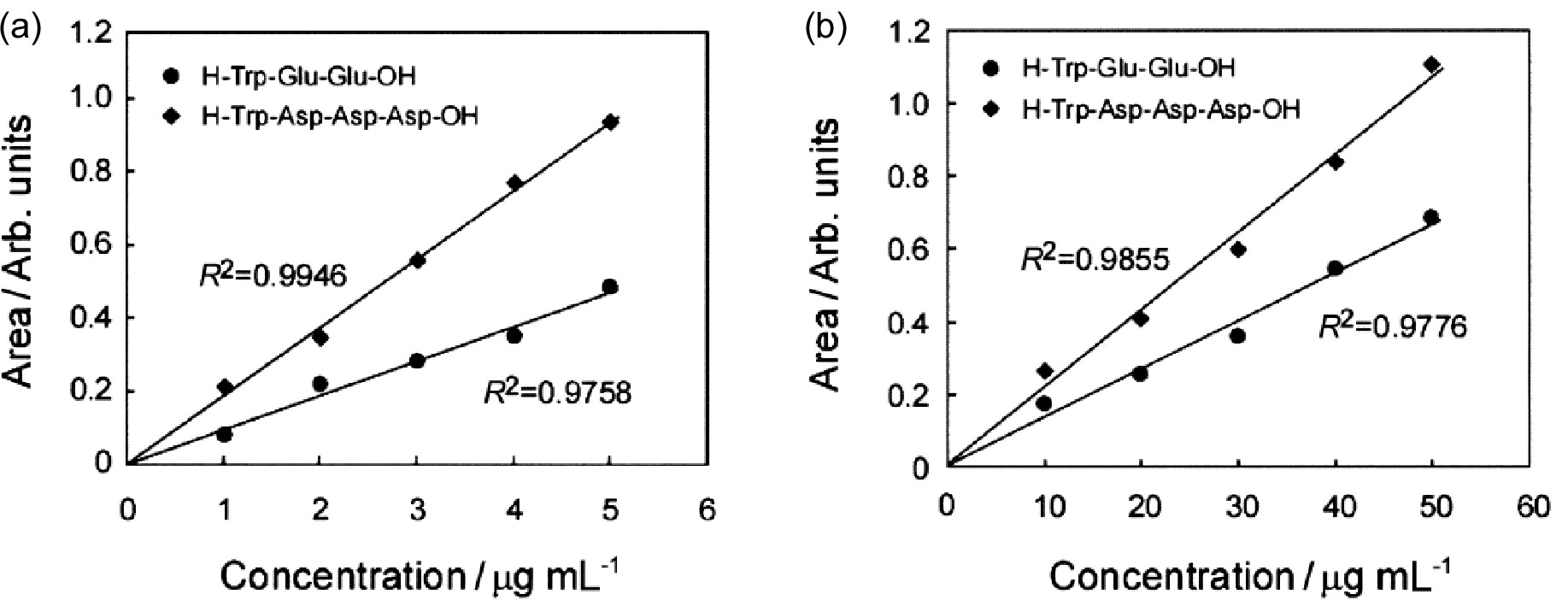
図3. 合成ペプチドの検量線 (a) UV-TLM (b) 吸光光度計を用いた場合
【関連文献】
- UV Excitation Thermal Lens Microscope for Sensitive
and Nonlabeled Detection of Nonfluorescent Molecules
Shinichiro Hiki, Kazuma Mawatari, Akihide Hibara, Manabu Tokeshi, and
Takehiko Kitamori
Anal. Chem., 78, 2859-2863 (2006).
- 紫外励起熱レンズ顕微鏡/液体クロマトグラフィーを用いるペプチドの無標識高感度検出
比企伸一郎, 渡慶次学, 角田正也, 馬渡和真, 菊谷善国, 佐藤記一, 火原彰秀, 志村清仁, 内田直行, 北森武彦
分析化学., 56, 1-7 (2007).





