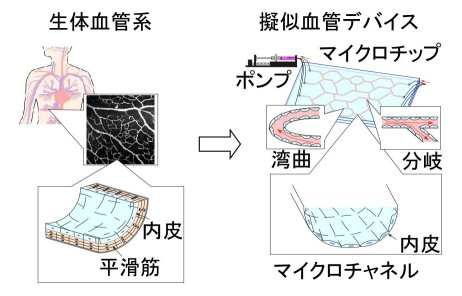
図1 擬似血管デバイスのコンセプト
擬似血管デバイスの創成
当研究室では心筋細胞の運動機能を利用した力学的機能の集積化を提唱し、化学エネルギーから力学エネルギーへの高効率変換機能をもった柔軟な生体材料である細胞を利用した、従来の電力駆動型デバイスとは根本的に異なる心筋細胞ポンプをはじめとする心筋細胞バイオマイクロアクチュエータを開発してきた(関連文献1参照)。しかしながら、心筋ポンプは必ずしも流量が安定しないため、一定の流量を得るためには流量のフィードバック制御が必要である。そこで、本研究では血管の流量調節機能に着目した。血管は、平滑筋細胞の内側を内皮細胞が覆っており、内皮細胞が血液中の化学・力学刺激を感知して様々なシグナル物質を放出し、これが平滑筋細胞に作用して血管を弛緩・収縮させ、血流を制御している。血管細胞機能の利用により、マイクロデバイスに流体制御機能を付与でき、不安定になりがちな心筋ポンプの流量制御に応用できると考えた。本研究では、まずセンサーの役割をする内皮細胞のマイクロチャネルでの培養・刺激を実証し、またアクチュエータの役割をする平滑筋細胞の駆動性能を見積もることにより、血管細胞マイクロ流体制御デバイス作製のための基礎的技術・知見の確立を目指した。これらの成果の詳細を以下に示す。
(1) 血管内皮細胞のマイクロデバイスへの組み込み
上で述べたように、血管の内面を覆う血管内皮細胞は、血流変化に応じて細胞の機能を変化させ、血液循環の恒常性を保持する性質を持つ。擬似血管デバイス構築のためには、血管内皮細胞の応答をin vitroで再現する必要があるが、血管はcmサイズの太い管とµmサイズの細い管からなる複雑な分岐構造を持つため、人工的にモデルを作るのは難しい。一方、我々は複雑な化学反応を高効率に実現するマイクロ化学チップやマイクロ細胞培養チップを多数開発している。マイクロチップはチャネル系の制御が容易であり、複雑・微小な血管を再現するのに最適なツールである(図1)。そこで本研究では、マイクロチップを血管に見立て、内皮細胞を培養し、刺激物質に対する応答を確認することを目的とした。

図1 擬似血管デバイスのコンセプト
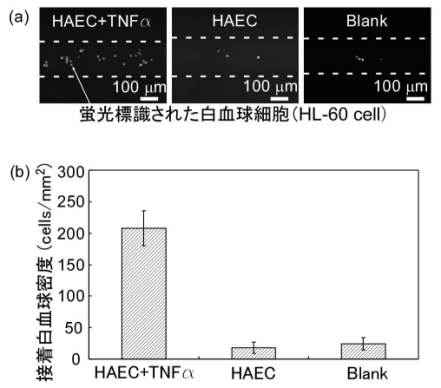
最も単純なモデルとして、直線で200 µm幅のマイクロチャネルに正常ヒト大動脈内皮細胞(HAEC)を導入し、培地を流し、数日間培養した後、白血球接着性を高める炎症性サイトカインTNFαでHAECを刺激し、蛍光染色した白血球HL-60を導入して10分後に洗浄し、蛍光画像から接着白血球数をカウントした。比較のため、刺激なしのHAEC培養チャネル、HAECを培養していない空のチャネルに関しても同様に実験した。図2より、TNFαで刺激したHAECを培養したチャネル(HAEC+TNFα)の白血球接着密度は、刺激なしのチャネル(HAEC)と空のチャネル(Blank)に比べて顕著に高いといえる。以上より、内皮細胞のマイクロチャネルでの培養および刺激が実証でき、内皮細胞に関する血管デバイスの基礎技術を確立したといえる(関連文献2参照)。
(2) 血管平滑筋細胞駆動型マイクロデバイスの原理検証
次に、内皮細胞を平滑筋細胞と組み合わせた、より生体に近い血管デバイスの設計及び試作を目的とし、平滑筋細胞のマイクロデバイスへの組み込みを実証した。具体的には、平滑筋細胞の化学刺激による駆動性能を評価した(図3)。ポリジメチルシロキサン(PDMS)のマイクロピラー上にラット大動脈平滑筋細胞を培養し、7日後、内皮細胞由来平滑筋収縮物質エンドセリン-1 (ET-1) (1 µM)で刺激したところ、細胞が接着したピラーの駆動が観測された。最大変位2.0 µm、発生力1.2 µN以上であった。次に、ET-1刺激後、平滑筋弛緩物質Y27632 (10 µM)を加えたところ、引っ張られたピラーが元に戻り、収縮・弛緩両方を実証できた。これらの結果から、血管平滑筋細胞に関する血管デバイス作製のための基礎的な知見が得られた(関連文献3参照)。今後、内皮と組み合わせた血管模倣型流体制御デバイスへと発展させる予定である。
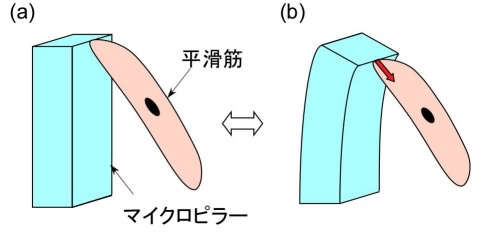
図3 平滑筋細胞によるピラー駆動実験 (a)細胞弛緩時 (b)細胞収縮時